Thérapies ciblées : la médecine de précision basée sur la génétique des tumeurs
 janv., 3 2026
janv., 3 2026
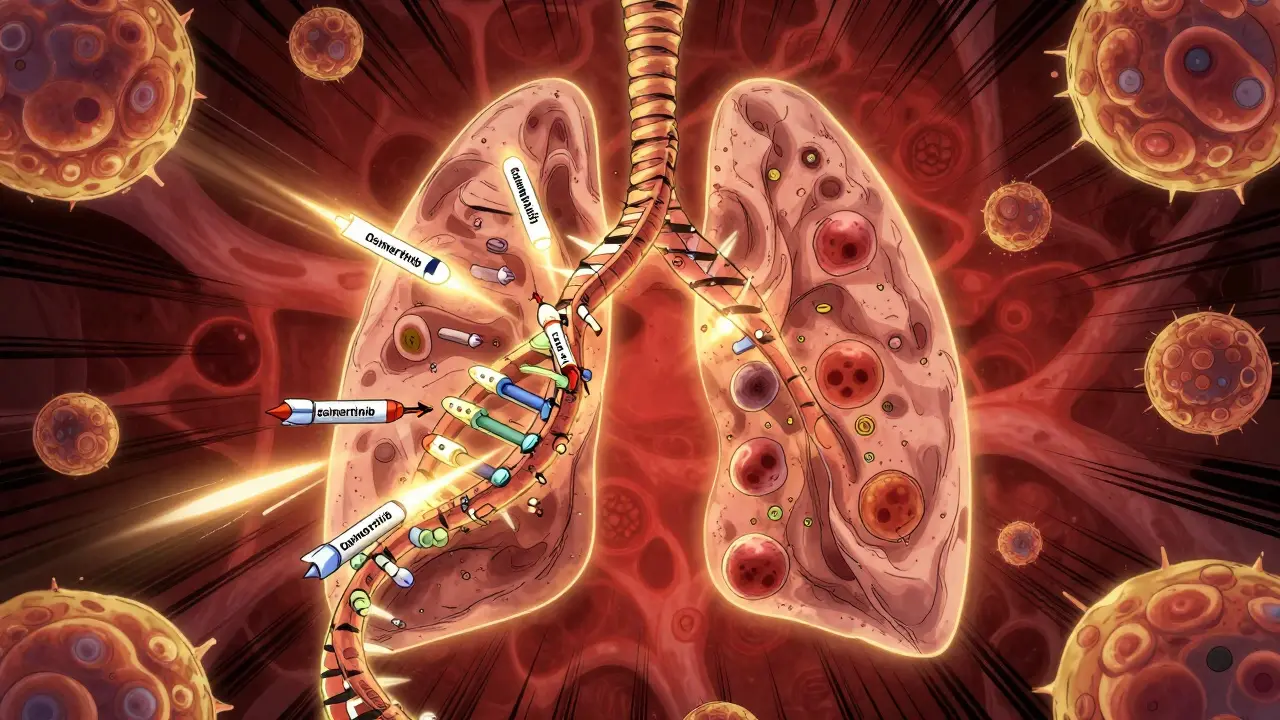
Avant les thérapies ciblées, traiter un cancer, c’était comme tirer à l’aveugle. La chimiothérapie frappait toutes les cellules qui se divisaient - les bonnes comme les mauvaises. Résultat : des effets secondaires dévastateurs, sans garantie que la tumeur réagisse. Aujourd’hui, tout a changé. Grâce à la génétique des tumeurs, les médecins peuvent maintenant voir exactement quelles mutations font pousser le cancer chez chaque patient. Et c’est là que la thérapie ciblée entre en jeu : un traitement qui frappe uniquement les cellules cancéreuses avec une précision inédite.
Comment ça marche ?
Les cellules cancéreuses ne sont pas comme les cellules normales. Elles portent des erreurs dans leur ADN, appelées mutations. Certaines de ces mutations activent des gènes qui font croître la tumeur - on les appelle des oncogènes. D’autres désactivent des gènes qui devraient empêcher le cancer - les gènes suppresseurs de tumeur. Les thérapies ciblées sont conçues pour bloquer précisément ces erreurs.
Prenons l’exemple de l’EGFR, un gène souvent muté dans le cancer du poumon. Chez les patients ayant cette mutation, le gène envoie un signal constant de croissance. Osimertinib, un médicament ciblé, bloque ce signal. Résultat ? La tumeur rétrécit. Dans l’essai FLAURA, les patients sous osimertinib ont vécu en moyenne 18,9 mois sans aggravation, contre seulement 10,2 mois avec la chimiothérapie classique. C’est une amélioration de 54 %.
Autre exemple : les tumeurs avec une fusion NTRK. Elles peuvent apparaître dans le sein, la thyroïde, le côlon, ou même le cerveau. Larotrectinib, lui, agit sur cette même fusion, peu importe l’organe d’origine. Dans les études, 75 % des patients ont vu leur tumeur réduire de moitié ou plus. C’est ce qu’on appelle une approche « histologie-agnostique » : on traite la mutation, pas l’endroit où elle se trouve.
Comment on trouve ces mutations ?
Pas de thérapie ciblée sans test génétique. Il faut d’abord analyser l’ADN de la tumeur. Pour ça, on utilise le séquençage de nouvelle génération (NGS). Ce n’est pas un simple test de sang. On prélève un échantillon de tumeur (biopsie), on extrait l’ADN, et on lit des centaines de gènes en même temps.
Les plateformes comme FoundationOne CDx ou MSK-IMPACT analysent entre 300 et 500 gènes liés au cancer. Le coût ? Environ 5 500 €. Il faut au moins 20 à 50 nanogrammes d’ADN, et la tumeur doit contenir au moins 20 % de cellules cancéreuses pour que le résultat soit fiable. Le délai ? Deux à trois semaines.
Et ce n’est pas toujours simple. Un tiers des résultats montrent des mutations dont on ne sait pas encore si elles sont actives ou non - on les appelle « variants d’incertitude ». Les oncologues doivent alors travailler avec des biologistes, des bioinformaticiens et des conseillers en génétique pour interpréter ces données. C’est pourquoi les centres spécialisés ont mis en place des « tables rondes moléculaires » : des réunions hebdomadaires où plusieurs experts discutent chaque cas.

Qui peut en bénéficier ?
Malheureusement, pas tout le monde. Seulement 13,8 % des patients atteints de cancer métastatique ont une mutation qui correspond à un traitement ciblé approuvé, selon les données du projet GENIE. Pour les cancers du poumon, du sein ou de la peau, ce taux peut monter jusqu’à 30-40 %. Pour d’autres, comme le cancer du pancréas, il tombe à moins de 5 %.
Et même quand on trouve une mutation, ça ne garantit pas que le traitement marchera pour toujours. Chez 70 à 90 % des patients, la tumeur développe une résistance après 9 à 14 mois. Elle trouve un autre chemin pour survivre. C’est pourquoi les chercheurs testent maintenant des combinaisons de traitements : un médicament ciblé + un immunothérapie, ou deux ciblés ensemble.
Le projet NCI-MATCH a montré que même chez les patients avec des cancers rares, si on trouve une mutation ciblable, il y a 35 % de chances que le traitement fonctionne. C’est une révolution : on ne traite plus le cancer en fonction de son origine (poumon, sein, côlon), mais en fonction de son code génétique.
Les limites et les inégalités
Les thérapies ciblées sont puissantes, mais elles ont des défauts. Le premier, c’est le prix. Un traitement peut coûter entre 15 000 et 30 000 € par mois. La chimiothérapie, elle, coûte 5 000 à 10 000 €. Pour beaucoup de patients, ce n’est pas juste une question de santé - c’est une question de survie financière. Une étude de l’Université de Chicago a révélé que 40 % des patients sous thérapie ciblée ont subi une détresse financière sévère.
Ensuite, l’accès est inégal. Aux États-Unis, 65 % des patients avancés ont un test génétique. En Europe, seulement 22 %. En Asie, 8 %. Dans les régions rurales ou les hôpitaux communautaires, les tests sont souvent inaccessibles. Selon l’ASCO, 55 % des patients ont vu leur demande de test refusée par leur assurance. Certains attendent plus de quatre semaines pour une autorisation. Pendant ce temps, la maladie progresse.
Et puis, il y a les patients avec des mutations rares. Un patient sur Reddit racontait avoir une fusion NTRK, mais son assurance a refusé de couvrir larotrectinib parce que « ce n’est pas un traitement standard pour son type de cancer ». Pourtant, les données montrent une réponse de 75 %, peu importe l’organe. C’est une injustice : la science a trouvé la clé, mais le système ne la laisse pas entrer.

Et maintenant ?
Le futur est dans la biopsie liquide. Plutôt que de faire une biopsie de tumeur à chaque fois, on peut maintenant analyser l’ADN des cellules cancéreuses qui flottent dans le sang. Le test Guardant360, approuvé par la FDA en 2023, permet de détecter les mutations de résistance trois à six mois avant que la tumeur ne grandisse sur une scanner. C’est comme avoir un radar qui prévient avant l’attaque.
Les chercheurs travaillent aussi sur des médicaments pour les gènes suppresseurs de tumeur, comme TP53. Ce sont les mutations les plus fréquentes - présentes dans 80 % des cancers - mais jusqu’à présent, aucune thérapie n’a réussi à les cibler. C’est le prochain grand défi.
Et l’intelligence artificielle ? IBM Watson pour l’oncologie a montré une concordance de 93 % avec les décisions des tables rondes moléculaires. Dans les années à venir, l’IA pourra proposer des combinaisons de traitements personnalisées, en analysant des milliers de cas en quelques secondes.
Que ressentent les patients ?
Sur les forums de soutien, les témoignages sont éloquents. Une patiente atteinte d’un cancer du poumon avancé avec mutation EGFR a écrit : « Après huit semaines sous osimertinib, ma tumeur a réduit de 80 %. Je n’ai pas eu de nausées, je n’ai pas perdu mes cheveux. J’ai pu retourner travailler. »
Un sondage de la Cancer Support Community en 2023 a montré que 68 % des patients sous thérapie ciblée ont pu maintenir leurs activités quotidiennes, contre seulement 42 % sous chimiothérapie. La qualité de vie est nettement meilleure.
Mais le chemin est encore long. Les patients veulent plus que des médicaments. Ils veulent un accès équitable. Une assurance qui ne les abandonne pas. Des médecins formés. Des tests rapides. Des essais pour les mutations rares. Et surtout, une promesse tenue : que la science ne soit pas un privilège, mais un droit.
Qu’est-ce qu’une thérapie ciblée ?
Une thérapie ciblée est un traitement qui agit sur des anomalies spécifiques dans l’ADN des cellules cancéreuses, comme des mutations dans des gènes comme EGFR, ALK ou NTRK. Contrairement à la chimiothérapie, elle ne touche que les cellules malades, ce qui réduit les effets secondaires.
Tout le monde peut-il bénéficier d’une thérapie ciblée ?
Non. Seuls les patients dont la tumeur présente une mutation ciblable par un médicament approuvé peuvent en bénéficier. Actuellement, seulement 13,8 % des patients atteints d’un cancer métastatique ont une mutation correspondante. Ce taux varie selon le type de cancer : plus élevé pour le poumon ou le mélanome, plus faible pour le pancréas ou l’ovaire.
Comment se fait le test génétique ?
On prélève un échantillon de tumeur (biopsie) ou, de plus en plus, un échantillon de sang (biopsie liquide). L’ADN est ensuite analysé avec un séquençage de nouvelle génération (NGS) qui examine entre 300 et 500 gènes liés au cancer. Le résultat prend 14 à 21 jours. Le coût est d’environ 5 500 €.
Pourquoi les thérapies ciblées coûtent-elles si cher ?
Le développement de ces médicaments est très coûteux : des années de recherche, des essais cliniques complexes, et des populations de patients très spécifiques. De plus, les laboratoires fixent des prix élevés pour amortir leurs investissements. Un traitement peut coûter jusqu’à 30 000 € par mois, contre 5 000 à 10 000 € pour la chimiothérapie.
Les thérapies ciblées guérissent-elles le cancer ?
Elles ne guérissent pas toujours, mais elles transforment souvent un cancer mortel en une maladie chronique. Pour certains patients, elles permettent de vivre plusieurs années avec une bonne qualité de vie. C’est déjà une avancée majeure. Mais la résistance se développe souvent après 9 à 14 mois, ce qui oblige à changer de traitement.
Jeanne Noël-Métayer
janvier 3, 2026 AT 13:05La thérapie ciblée repose sur une logique de profiling moléculaire hautement sophistiqué. L’analyse NGS permet d’identifier des variants somatiques à haute fréquence d’occurrence, mais la complexité vient des variants d’incertitude de signification (VUS), qui représentent jusqu’à 30 % des résultats. L’interprétation nécessite une intégration multi-omique : transcriptome, protéome, et parfois métabolome. Sans pipeline bioinformatique robuste et des bases de données comme COSMIC ou ClinVar, on est dans le flou total. Et oui, c’est encore du domaine de la recherche translationnelle, pas de la routine clinique.
Antoine Boyer
janvier 5, 2026 AT 10:14Je trouve cette avancée profondément humaine. La médecine ne traite plus une maladie abstraite, mais un individu spécifique, avec son propre code génétique. C’est une révolution éthique autant que scientifique. Bien sûr, les coûts et les inégalités d’accès sont inacceptables - mais ce n’est pas une raison d’arrêter. C’est une raison de lutter plus fort. Il faut que chaque patient, partout, ait droit à ce niveau de précision. La science n’est pas un luxe. Elle est un pilier de la dignité humaine.
fleur challis
janvier 5, 2026 AT 23:46Ah oui bien sûr, la médecine de précision… comme si les labos n’avaient pas inventé ça juste pour vendre des traitements à 30k€/mois. 🤡 On nous dit que c’est révolutionnaire, mais en réalité, c’est juste un nouveau business model pour les multinationales. Et pendant ce temps, les hôpitaux publics n’ont même pas assez de pipettes pour faire un test de base. La biopsie liquide ? Un gadget pour riches. Et les patients avec des mutations rares ? On les met dans un tiroir labeled ‘à investiguer plus tard’… comme toujours. #PharmaLies
Alain Sauvage
janvier 6, 2026 AT 00:03Je suis émerveillé par la notion d’approche histologie-agnostique. C’est comme si on passait d’une cartographie géographique à une cartographie génétique. Larotrectinib sur une fusion NTRK, que ce soit dans le poumon ou le cerveau… c’est incroyablement élégant. Mais je me demande : est-ce qu’on devrait standardiser les panels de séquençage en France ? Actuellement, chaque centre utilise son propre kit, et les résultats ne sont pas toujours comparables. Une harmonisation nationale serait un vrai progrès.
Nicole Frie
janvier 7, 2026 AT 14:40Vous croyez vraiment que ces traitements marchent ? Moi j’ai vu un cousin mourir en 6 mois avec osimertinib… et il avait la mutation EGFR. Donc c’est juste du vent marketing. La chimio, au moins, tu sais ce que tu vas avoir : des nausées, mais pas de fausses espérances.
vincent PLUTA
janvier 8, 2026 AT 03:29Je suis oncologue dans un hôpital de province. Je peux vous dire que les tables rondes moléculaires, c’est notre seul espoir. Sans elles, on se perd dans les VUS. Une fois, on a eu un patient avec une mutation rare dans le gène RET - personne ne la connaissait. On a contacté un labo aux États-Unis, ils ont fait une analyse en 72h, et on a trouvé un essai clinique en cours. Il vit encore. C’est ça, la médecine moderne : du réseau, de la collaboration, et une bonne dose de détermination. Mais sans financement public, tout ça s’effondre.
Clio Goudig
janvier 8, 2026 AT 05:48On parle de révolution… mais en réalité, on fait juste un peu mieux qu’avant. Et encore. La plupart des patients voient leur tumeur rétrécir… puis elle revient, plus forte. C’est comme une partie d’échecs contre un adversaire qui triche. Et les coûts ? On a créé une élite médicale qui traite les riches et laisse les autres crever. La vraie révolution, ce serait de rendre la chimio efficace et abordable. Pas de vendre des médicaments à prix d’or pour des cas qui représentent 14 % de la population.
Dominique Hodgson
janvier 9, 2026 AT 17:37Les gènes ça sert à rien en vrai. Le vrai cancer c’est quand t’as pas de force dans les bras et que t’as pas mangé depuis 3 jours. Les tests coûteux c’est de la poudre aux yeux. Les Américains et les riches français se font traiter avec des trucs de fou et les autres ils meurent dans les salles d’attente. La France c’est un pays de cons. On parle de génétique alors qu’on n’a même pas assez de médecins pour les vieux. La science c’est un luxe pour les bourgeois. La vraie médecine c’est la main sur le front et la pilule à 2 euros.
Yseult Vrabel
janvier 10, 2026 AT 23:59Je veux juste dire… MERCI. À tous les chercheurs, les biologistes, les infirmiers qui bossent en nuit pour faire les tests. Vous êtes des héros invisibles. J’ai survécu 5 ans avec une mutation ALK grâce à alectinib. J’ai vu des amis partir. J’ai pleuré. J’ai repris le vélo. J’ai retrouvé mes enfants. Ce n’est pas juste un traitement. C’est une seconde vie. Et oui, c’est cher. Et oui, c’est inégal. Mais ça existe. Et ça donne de l’espoir. Alors ne dites pas que c’est du vent. Pour certains d’entre nous… c’est le seul vent qui nous porte.
Bram VAN DEURZEN
janvier 12, 2026 AT 04:30Il convient de noter que la standardisation des panels NGS en Europe reste lacunaire. La directive 98/79/CE relative aux diagnostics in vitro n’est pas uniformément appliquée, ce qui génère des disparités interrégionales dans la qualité des analyses. En outre, le coût des licences logicielles pour l’interprétation bioinformatique est souvent sous-estimé. Il est impératif que l’Union européenne élabore un cadre réglementaire harmonisé, fondé sur les recommandations de l’ESMO, afin d’assurer une équité d’accès à la médecine de précision. La France, en tant que puissance scientifique, devrait prendre la tête de cette initiative.
Eveline Hemmerechts
janvier 13, 2026 AT 04:10On parle de gènes, de mutations, de précision… mais personne ne parle de la solitude. Le patient qui attend trois semaines pour un résultat, qui lit sur Internet ce que ça veut dire, qui se demande s’il va vivre assez longtemps pour voir son enfant grandir. La science peut tout corriger… sauf la peur. Et c’est là que la compassion devient plus importante que le séquençage.