Facteurs de croissance tumoraux : définition, mécanismes et applications cliniques
 oct., 10 2025
oct., 10 2025
Simulateur de Facteurs de Croissance Tumorale
PDGF
Facteur de croissance dérivé du plaquette
FGF
Facteur de croissance fibroblastique
VEGF
Facteur vasculaire endothélial de croissance
EGF
Facteur de croissance épidermique
TGF-β
Transforming Growth Factor beta
Détails du Facteur Sélectionné
Sélectionnez un facteur de croissance ci-dessus pour voir ses détails.
Applications Thérapeutiques
Les applications thérapeutiques des facteurs de croissance sont utilisées dans le traitement du cancer. Les anticorps monoclonaux et les inhibiteurs de tyrosine kinase sont des exemples courants.
Vous avez sans doute entendu parler de Facteurs de croissance tumoraux lorsqu’on discute de la progression du cancer, mais leur rôle exact reste souvent flou. Ces protéines agissent comme des messagers qui poussent les cellules cancéreuses à se multiplier, à envahir les tissus voisins et à créer de nouveaux vaisseaux sanguins. Cet article vous explique clairement ce que sont ces facteurs, comment ils déclenchent la croissance tumorale et quelles stratégies médicales s’en servent pour freiner la maladie.
Résumé rapide
- Les facteurs de croissance tumoraux sont des protéines qui stimulent la prolifération, la survie et l’angiogenèse des cellules cancéreuses.
- Les principaux acteurs sont le PDGF, le FGF, le VEGF, l’EGF et le TGF‑β, chacun se liant à un récepteur spécifique.
- Ces molécules déclenchent des voies de signalisation comme MAPK/ERK, PI3K/AKT ou SMAD, qui contrôlent la division cellulaire et l’évasion apoptotique.
- Le ciblage thérapeutique (anticorps monoclonaux, inhibiteurs de tyrosine kinase) a déjà permis d’améliorer la survie dans plusieurs cancers.
- Une surveillance des résistances et des effets secondaires est indispensable pour optimiser ces traitements.
Qu’est‑ce qu’un facteur de croissance tumoral ?
Un facteur de croissance tumoral est une protéine sécrétée par les cellules tumorales ou le micro‑environnement qui active des récepteurs membranaires et déclenche une cascade de signaux intracellulaires. Leur fonction normale est de réguler la croissance, la différenciation et la réparation des tissus ; dans le cancer, ils sont détournés pour favoriser la multiplication incontrôlée.
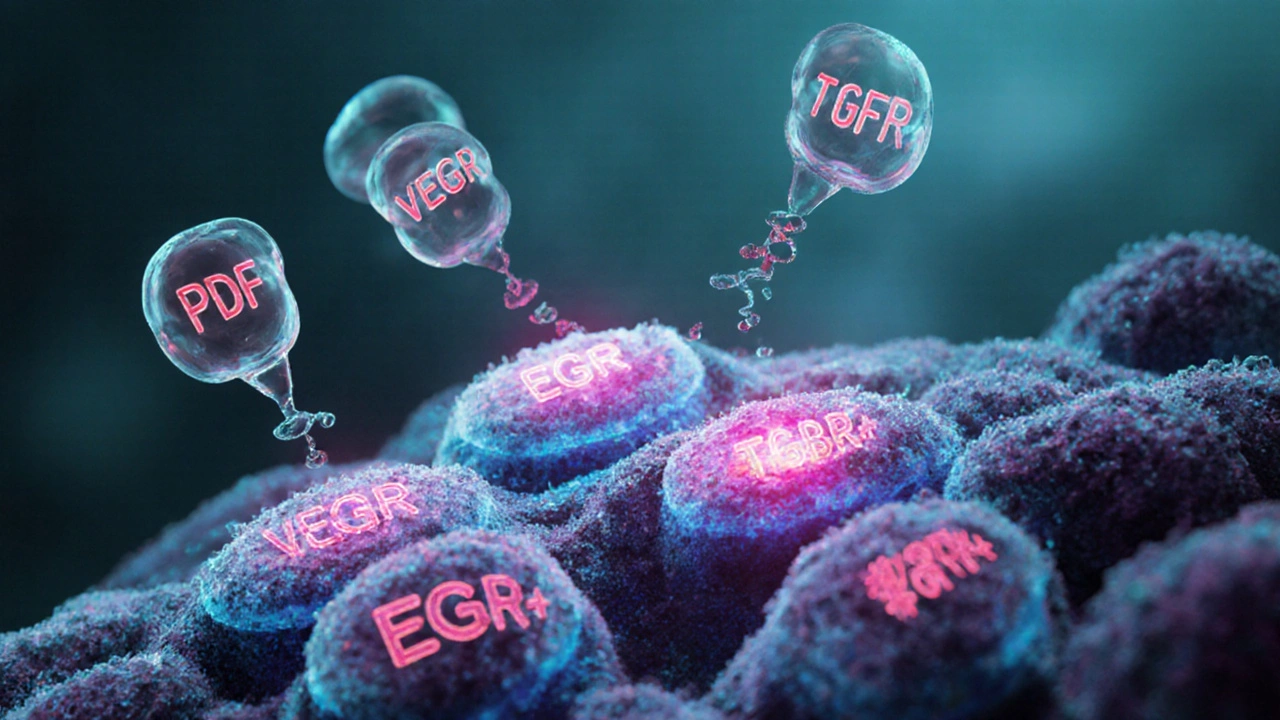
Principaux facteurs de croissance et leurs récepteurs
PDGF (Facteur de croissance dérivé du plaquette) est un homodimère qui se lie aux récepteurs PDGFR‑α et PDGFR‑β. Il stimule surtout les cellules mésenchymateuses et est fortement présent dans les sarcomes et certains gliomes.
FGF (Facteur de croissance fibroblastique) agit via les récepteurs FGFR1‑4. Il favorise l’angiogenèse et la migration cellulaire, notamment dans les cancers du sein et de la prostate.
VEGF (Facteur vasculaire endothélial de croissance) se fixe aux récepteurs VEGFR‑1, VEGFR‑2 et VEGFR‑3. Sa fonction phare est la formation de nouveaux vaisseaux sanguins qui alimentent la tumeur.
EGF (Facteur de croissance épidermique) active le récepteur EGFR, largement surexprimé dans le cancer du poumon non‑petit‑cellule et le cancer colorectal.
TGF‑β (Transforming Growth Factor beta) agit via les récepteurs TGFBR1/2. Il joue un rôle double: suppression tumorale précoce puis promotion de la métastase dans les stades avancés.
Tableau comparatif des facteurs majeurs
| Facteur | Récepteur principal | Fonction clé | Cancers associés | Cible thérapeutique |
|---|---|---|---|---|
| PDGF | PDGFR‑α/β | Prolifération des cellules mésenchymateuses | Sarcome, gliome | Imatinib, sunitinib |
| FGF | FGFR1‑4 | Angiogenèse, migration | Cancer du sein, prostate | BGJ398, erdafitinib |
| VEGF | VEGFR‑1/2/3 | Formation vasculaire | CRC, NSCLC, RCC | Bevacizumab, ramucirumab |
| EGF | EGFR | Prolifération cellulaire | NSCLC, colorectal | Erbitux, osimertinib |
| TGF‑β | TGFBR1/2 | Émancipation immunitaire, métastase | Pancréas, mélanome | Galunisertib, fresolimumab |
Comment les facteurs de croissance stimulent la croissance tumorale
Lorsque le facteur se lie à son récepteur, celui‑ci dimerise et se phosphoryle, activant des kinases intracellulaires. Trois voies dominantes sont fréquemment citées:
- La voie MAPK/ERK: favorise la transcription de gènes cyclines (cycline D1, cycline E) qui poussent le cycle cellulaire du point G1 vers S.
- La voie PI3K/AKT: bloque l’apoptose en activant mTOR et en inhibant pro‑apoptotiques comme BAD.
- La voie SMAD (pour TGF‑β): régule la matrice extracellulaire, la migration et l’évasion immunitaire.
Ces cascades se recoupent, créant un réseau de rétro‑actions qui rend la tumeur résiliente aux signaux anti‑croissance. Par exemple, une activation prolongée d’AKT peut compenser l’inhibition d’ERK, expliquant les résistances aux inhibiteurs ciblés.
Implications cliniques : du diagnostic à la thérapie
Le dosage des facteurs ou de leurs récepteurs dans le sang ou le tissu tumoral sert de biomarqueur. Un taux élevé de VEGF dans le plasma d’un patient atteint de cancer colorectal prédit souvent une réponse favorable aux anti‑VEGF.
Les thérapies anti‑facteurs de croissance sont aujourd’hui standards:
- Anticorps monoclonaux (ex.: bevacizumab contre le VEGF) qui neutralisent la protéine circulante.
- Inhibiteurs de tyrosine kinase (TKI) (ex.: sunitinib qui bloque PDGFR et VEGFR).
- Vaccins thérapeutiques qui incitent le système immunitaire à reconnaître les récepteurs sur les cellules tumorales.
Ces traitements améliorent la survie globale, mais ils sont souvent limités par des mécanismes de résistance (mutations du récepteur, activation de voies de contournement, expression accrue de transporteurs d’efflux).
Exemple concret: le ciblage du VEGF dans le cancer du poumon non‑petit‑cellule
Un patient de 62ans, fumeur, reçoit du bevacizumab en combinaison avec une chimio‑doublet (carboplatine‑paclitaxel). Après 6cycles, l’imagerie montre une réduction de 45% du volume tumoral. Cependant, à la 12ᵉsemaine, les tumeurs récidivent, et une biopsie révèle une substitution ponctuelle du domaine ligand‑binding du VEGFR‑2, rendant le bevacizumab inefficace. Le changement de stratégie vers un TKI multi‑cibles (pazopanib) permet de reprendre le contrôle de la maladie, illustrant la nécessité d’une surveillance moléculaire continue.
Points d’attention et perspectives d’avenir
Malgré les succès, plusieurs défis subsistent:
- Résistance acquise: les tumeurs trouvent rapidement des voies de contournement.
- Toxicité: inhibition de la voie VEGF peut causer hypertension, thromboses ou troubles de la cicatrisation.
- Hétérogénéité tumorale: toutes les cellules d’une même tumeur n’expriment pas identiquement les récepteurs.
Les recherches se dirigent vers des approches combinées (anti‑VEGF + immunothérapie), des inhibiteurs allostériques plus sélectifs et l’utilisation de l’édition génétique CRISPR pour désactiver de façon permanente les gènes des récepteurs sur les cellules cancéreuses.
Conclusion pratique
Les facteurs de croissance tumoraux sont au cœur du développement et de la diffusion du cancer. Les connaître, les mesurer et les cibler permet d’ajuster le traitement de façon personnalisée. Restez attentif aux signes de résistance et discutez avec votre oncologue des options combinées qui pourraient renforcer l’efficacité du traitement.
FAQ
Quels sont les facteurs de croissance les plus impliqués dans le cancer du sein ?
Le FGF, le VEGF et le TGF‑β sont fréquemment surexprimés dans les tumeurs mammaires. Leurs récepteurs (FGFR, VEGFR, TGFBR) sont associés à une progression plus rapide et à un risque de métastase osseuse.
Comment le dosage du VEGF aide‑t‑il au suivi thérapeutique ?
Un taux plasmique élevé de VEGF avant traitement prédit généralement une bonne réponse aux anti‑VEGF. Un suivi régulier permet de détecter une hausse qui pourrait signaler une résistance.
Pourquoi les inhibiteurs de tyrosine kinase provoquent souvent de l’hypertension ?
Ils bloquent la voie VEGF, qui régule la production d’oxyde nitrique dans les vaisseaux. La réduction de ce vasodilatateur augmente la résistance vasculaire, d’où l’hypertension.
Le TGF‑β est‑il toujours mauvais dans le cancer ?
Non. Au stade précoce, le TGF‑β peut inhiber la croissance cellulaire. Ce n’est qu’à un stade avancé qu’il devient promoteur de métastase et d’immunosuppression.
Existe‑t‑il des alternatives naturelles aux anti‑facteurs de croissance ?
Certaines études suggèrent que les polyphénols (curcumine, resvératrol) peuvent moduler les voies MAPK et PI3K, mais les données cliniques restent limitées. Ils ne remplacent pas une thérapie prescrite.
Francine Azel
octobre 10, 2025 AT 20:09Ah, les facteurs de croissance tumoraux, ce sont un peu comme les philosophes du micro‑univers, toujours en train de débattre sur qui a le droit de pousser la vie à son maximum. Mais au lieu de siroter du café dans l’Agora, ils font pousser des cellules comme des mauvaises herbes. Bien sûr, il faut les contrôler, sinon on se retrouve avec un jardin envahi. Les effets secondaires, c’est le petit prix à payer pour un peu de thérapie ciblée, n’est‑ce pas ? En fin de compte, c’est une question d’équilibre entre ambition et modération, même pour les protéines.
Vincent Bony
octobre 18, 2025 AT 22:40Super intéressant le simulateur, même si je reste sceptique sur l’impact réel de ces cartes interactives. On a l’impression que la science devient un jeu vidéo, mais la réalité clinique est bien plus rude. Ça montre bien que la plupart des patients ne comprennent pas toujours ce qu’on leur propose.
bachir hssn
octobre 27, 2025 AT 00:10Quel douce illusion d'être rassuré par ces listes de molécules alors que le cancer demeure un système complexe et adaptatif. Les inhibiteurs de kinases sont présentés comme des solutions magiques alors qu'ils ne font que temporiser la résistance tissulaire. Par ailleurs, la redondance des voies MAPK et PI3K ne laisse aucune marge de manœuvre aux traitements monothérapeutiques. En bref, le texte simplifie à l'extrême une biologie qui se nourrit de contradictions.
Marion Olszewski
novembre 4, 2025 AT 02:41J'apprécie la clarté de l'exposé, notamment la façon dont chaque facteur est associé à ses récepteurs, ce qui facilite la compréhension des voies de signalisation. Toutefois, il aurait été judicieux d'inclure davantage de références cliniques, afin de soutenir les affirmations avec des données probantes. De plus, une mise en garde concernant les effets indésirables des anti‑VEGF aurait enrichi le tableau. Enfin, la table comparative est très lisible, bien structurée, et permet de saisir rapidement les différences majeures.
Michel Rojo
novembre 12, 2025 AT 05:11En fait, le fait que le VEGF soit mesuré dans le sang, ça montre bien que la médecine essaie de pousser la précision. J'me demande comment ces biomarqueurs sont intégrés dans le suivi quotidien, surtout quand la résistance apparaît.
Shayma Remy
novembre 20, 2025 AT 07:42Il est inadmissible que l'on continue de prescrire des TKIs sans surveillance moléculaire adéquate. Les protocoles doivent obligatoirement inclure des biopsies de suivi afin de détecter les mutations qui neutralisent le traitement. Sans cela, on ne fait que prolonger la souffrance du patient.
Albert Dubin
novembre 28, 2025 AT 10:12j'étais un peu perdu entre les termes, mais maintenant c'est plus cooool. c'est vrai que le truc du TGF‑β change d'avis selon le stade.
Christine Amberger
décembre 6, 2025 AT 12:43Franchement, la surabondance de points‑virgules me donne des frissons 🙄. Si on veut réellement clarifier les mécanismes, il faut simplifier le jargon et éviter les redondances inutiles. On dirait un menu à la carte qui veut tout faire à la fois.
henri vähäsoini
décembre 14, 2025 AT 15:13Le point que vous avez soulevé concernant l'importance du suivi biomarqueur mérite d'être développé plus en profondeur. En pratique clinique, la mesure du VEGF circulant, par exemple, fournit une indication dynamique de la réponse tumorale, mais elle doit être interprétée dans le contexte de la pharmacocinétique du médicament administré. Lorsque le patient initie un traitement anti‑VEGF, on observe souvent une chute initiale du taux plasmique, suivi d'une stabilisation ou d'une remontée progressive qui signale généralement le développement d'une résistance. Cette remontée est souvent liée à des mutations du domaine ligand‑binding du récepteur VEGFR‑2, comme vous l'avez mentionné, mais la littérature indique également que des mécanismes de contournement via l'activation de voies alternatives, telles que le PDGFR ou le FGFR, peuvent être mis en œuvre par les cellules tumorales. Il est donc crucial d'adapter les protocoles de suivi en intégrant des analyses génomiques de biopsies de rechute, permettant ainsi de détecter les altérations spécifiques et d'orienter le choix du traitement de seconde ligne. Par ailleurs, les stratégies combinées, associant anti‑VEGF et immunothérapie, ont montré un bénéfice supplémentaire, en particulier chez les patients dont la charge tumorale résiduelle reste élevée après la première ligne de thérapie ciblée. L'effet synergique provient du fait que l'inhibition de l'angiogenèse normalise le réseau vasculaire, favorisant l'infiltration des lymphocytes T, et ainsi amplifie la réponse immunitaire. Cependant, il faut être vigilant quant aux effets indésirables, notamment l'hypertension et les risques de saignement, qui nécessitent un suivi cardio‑vasculaire strict. Enfin, l'utilisation d'outils numériques, comme les plates‑formes de suivi en temps réel des biomarqueurs, ouvre la voie à une médecine véritablement personnalisée, où chaque ajustement thérapeutique est guidé par des données concrètes et actualisées. En conclusion, le suivi du niveau de VEGF et des autres biomarqueurs, couplé à des analyses moléculaires répétées, constitue aujourd'hui le pilier d'une approche thérapeutique adaptative, capable de contourner les mécanismes d'évasion tumorale et d'optimiser la survie des patients.
Winnie Marie
décembre 22, 2025 AT 17:44Vous avez oublié de mentionner que la plupart des essais cliniques négligent les différences ethniques dans la réponse aux anti‑VEGF, ce qui fausse les résultats globaux et rend les conclusions un peu trop optimistes. C’est un point que les études de phase III auraient dû anticiper, mais qui reste souvent sous‑exploré.
Stéphane Leclerc
décembre 30, 2025 AT 20:14Ça montre bien que même les détails apparemment mineurs, comme la gestion du suivi, peuvent transformer une thérapie ciblée en véritable succès clinique. Continuons à partager ces bonnes pratiques !
thibault Dutrannoy
janvier 7, 2026 AT 22:45En tout cas, le débat est passionnant et montre que chaque point de vue enrichit notre compréhension. Restons optimistes et ouverts aux nouvelles approches.