Azathioprine et Allopurinol : Comment éviter l'accumulation de métabolites toxiques
 janv., 28 2026
janv., 28 2026
Si vous prenez de l’azathioprine pour une maladie inflammatoire de l’intestin, une hépatite auto-immune ou après une transplantation, et que vos enzymes hépatiques sont élevées malgré un bon dosage, vous n’êtes pas seul. Beaucoup de patients vivent cette situation : le médicament ne fonctionne pas, ou pire, il endommage le foie. La solution n’est pas toujours de changer de traitement. Parfois, il suffit d’ajouter un autre médicament, bien connu pour traiter la goutte : l’allopurinol. Ensemble, ils forment une combinaison appelée LDAA - azathioprine à faible dose avec allopurinol - qui redirige le métabolisme du médicament pour éviter les toxines et améliorer les résultats.
Comment l’azathioprine fonctionne (et pourquoi elle peut être toxique)
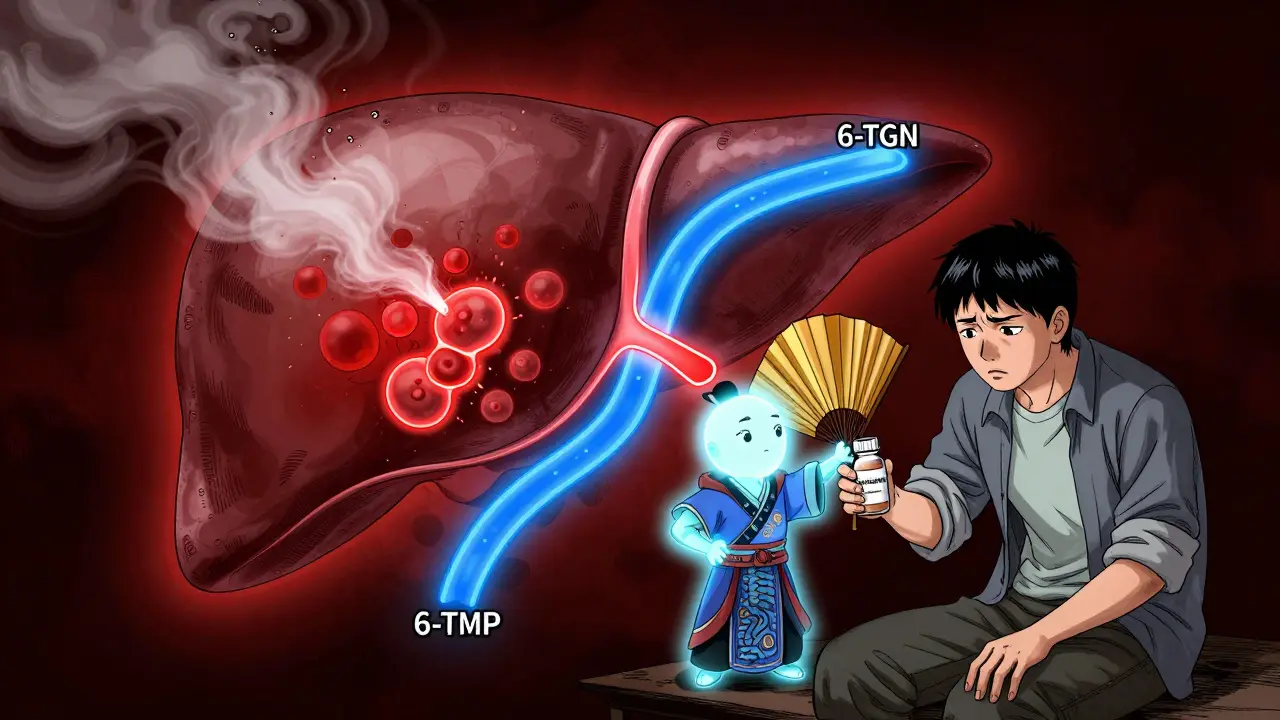
L’azathioprine est un médicament immunosuppresseur utilisé depuis les années 1970. Il ne fait pas grand-chose tout seul. Dans le corps, il se transforme en 6-mercaptopurine (6-MP), qui entre alors dans trois voies métaboliques différentes. Une partie devient du 6-thioguanine nucléotides (6-TGN), la forme thérapeutique qui réduit l’inflammation. Une autre partie devient du 6-méthylmercaptopurine (6-MMP), un métabolite qui n’a aucun effet anti-inflammatoire… mais qui endommage le foie. La troisième partie est éliminée inutilement.
C’est là que le problème se pose. Environ 15 à 20 % des patients ont une activité trop élevée d’une enzyme appelée TPMT. Ces patients, appelés « hyperméthylateurs », transforment presque tout leur 6-MP en 6-MMP. Résultat : des enzymes hépatiques élevées, des nausées, une fatigue persistante - et aucun contrôle de la maladie. Ils ne répondent pas à l’azathioprine, non pas parce qu’elle est inefficace, mais parce qu’elle est mal métabolisée.
Le rôle de l’allopurinol : un médicament de goutte qui sauve la thérapie
L’allopurinol a été conçu pour traiter la goutte en bloquant une enzyme appelée xanthine oxydase. Mais cette même enzyme, dans le métabolisme de l’azathioprine, transforme une partie du 6-MP en acide thiourique, une forme inerte. Quand on bloque cette enzyme avec de l’allopurinol, le corps n’a plus le choix : il doit envoyer plus de 6-MP vers la voie du 6-TGN. C’est là que tout change.
En combinant une dose réduite d’azathioprine (50 mg par jour au lieu de 150-200 mg) avec 100 mg d’allopurinol, on observe une augmentation de 2 à 5 fois du taux de 6-TGN dans les globules rouges. En même temps, le 6-MMP chute de 70 à 90 %. Pour les patients hyperméthylateurs, cela signifie : des enzymes hépatiques qui reviennent à la normale, une amélioration de la maladie, et moins d’effets secondaires.
Comment savoir si vous êtes un bon candidat pour cette combinaison
Vous n’avez pas besoin d’essayer cette combinaison au hasard. Il existe des tests simples pour le savoir. Un test sanguin mesure l’activité de l’enzyme TPMT. Si elle est supérieure à 14,2 U/mL, vous êtes probablement un hyperméthylateur. Mais le test le plus fiable est la surveillance thérapeutique des métabolites : on mesure les taux de 6-TGN et de 6-MMP dans vos globules rouges.
Si vos taux sont comme ceci :
- 6-TGN : inférieur à 230 pmol/8×10⁸ RBC
- 6-MMP : supérieur à 5 700 pmol/8×10⁸ RBC
Alors vous êtes un candidat idéal pour l’LDAA. Ce n’est pas une option de dernier recours. C’est une stratégie précise pour ceux qui ne répondent pas à l’azathioprine seule. Des études montrent que 65 à 75 % des patients hyperméthylateurs atteignent la rémission avec cette combinaison, contre seulement 30 à 40 % avec la dose standard.

Les risques : pourquoi la surveillance est obligatoire
Le principal danger de cette combinaison ? La suppression de la moelle osseuse. Si vous prenez une dose normale d’azathioprine avec de l’allopurinol, vous risquez une leucopénie sévère, voire une aplasie médullaire. C’est ce qui a fait peur aux médecins dans les années 1980, et c’est pourquoi cette combinaison a été longtemps évitée.
Mais la clé est dans la dose. À 50 mg d’azathioprine par jour, avec 100 mg d’allopurinol, le risque de suppression médullaire tombe à 5-10 %, comparable à celui de l’azathioprine seule. Ce n’est pas un risque nul - mais il est maîtrisable. La règle est simple :
- Commencez avec 50 mg d’azathioprine et 100 mg d’allopurinol par jour.
- Faites un bilan sanguin complet chaque semaine pendant 4 semaines.
- À la semaine 4, faites un test de métabolites pour vérifier les taux de 6-TGN et de 6-MMP.
- Si le 6-TGN est entre 230 et 450 pmol/8×10⁸ RBC, vous êtes dans la zone thérapeutique.
- Si le 6-TGN dépasse 450, réduisez la dose d’azathioprine de 25 %.
Un patient sur cinq peut développer une leucopénie entre la 4e et la 8e semaine. Ce n’est pas une raison d’arrêter. En général, en suspendant temporairement l’azathioprine pendant 1 à 2 semaines, puis en la réintroduisant à une dose légèrement plus faible, la moelle osseuse se rétablit sans dommage durable.
Ce que disent les patients et les médecins
Sur les forums de patients, les témoignages sont partagés. Certains racontent que cette combinaison leur a sauvé la vie : « Après 3 ans d’azathioprine sans résultat, j’ai eu des enzymes hépatiques normales en 8 semaines. Je suis en rémission depuis 14 mois. » D’autres racontent des expériences terribles : « J’ai été hospitalisé parce que mon taux de neutrophiles est tombé à 0,8. J’ai eu de la fièvre. »
La différence ? La surveillance. Les patients qui ont suivi les protocoles ont réussi. Ceux qui ont commencé sans contrôle ont eu des complications. Les gastro-entérologues qui utilisent cette combinaison régulièrement ont une note moyenne de 4,7/5 sur les plateformes de notation. Ceux qui l’évitent ont 4,2/5 - pas parce qu’elle est dangereuse, mais parce qu’elle demande du travail.

Qui ne doit pas la prendre
Cette combinaison n’est pas pour tout le monde. Elle est contre-indiquée si :
- Votre taux de TPMT est très bas (inférieur à 5 U/mL) - vous êtes déjà à haut risque de suppression médullaire.
- Vos reins sont très endommagés (clairance de la créatinine < 30 mL/min) - l’allopurinol s’accumule.
- Vous avez déjà eu une suppression médullaire sévère avec un autre immunosuppresseur.
Si vous êtes dans l’un de ces cas, d’autres options existent : les anti-TNF (comme l’infliximab), les inhibiteurs de JAK, ou les anticorps anti-intégrines. Mais si vous êtes un hyperméthylateur, l’LDAA est souvent la meilleure option avant d’opter pour des traitements bien plus chers.
Coût et accessibilité : pourquoi c’est une révolution pour les systèmes de santé
Un traitement par anti-TNF coûte entre 30 000 et 50 000 euros par an. L’azathioprine seule coûte environ 300 euros. Avec l’allopurinol, le coût total de l’LDAA est de 1 200 à 1 800 euros par an. C’est une économie de 95 %.
En Europe, 65 % des centres spécialisés en maladies inflammatoires de l’intestin proposent maintenant cette combinaison, contre seulement 12 % en 2015. Aux États-Unis, elle est moins répandue, mais les recommandations de l’American Gastroenterological Association (AGA) en 2023 l’ont officialisée comme traitement de choix pour les patients intolérants à l’azathioprine.
Les hôpitaux universitaires l’utilisent plus souvent que les cliniques privées. Pourquoi ? Parce qu’elle demande un suivi rigoureux. Ce n’est pas une ordonnance à donner en 5 minutes. C’est un traitement qui nécessite une équipe, des analyses, et un suivi à long terme.
Le futur : des tests rapides pour guider la dose
Actuellement, mesurer les métabolites prend plusieurs jours. Mais deux nouveaux dispositifs sont en phase 3 d’essais cliniques. Ils permettront de connaître les taux de 6-TGN et de 6-MMP en moins de 2 heures, directement au cabinet du médecin. Ce sera un changement majeur : pas besoin d’envoyer le sang au laboratoire. On ajuste la dose le jour même.
Les analystes prévoient une croissance annuelle de 45 % de l’usage de l’LDAA jusqu’en 2027. Ce n’est pas une mode. C’est une approche scientifique, bien étudiée, et économique. Elle repose sur une compréhension fine du métabolisme humain - pas sur des essais au hasard.
Si vous avez une maladie inflammatoire de l’intestin et que l’azathioprine ne fonctionne pas, demandez à votre médecin : « Est-ce que mes métabolites ont été mesurés ? » Si la réponse est non, demandez un test. Vous pourriez être un candidat parfait pour cette combinaison. Et vous n’avez peut-être pas besoin de passer à un traitement 25 fois plus cher pour retrouver votre qualité de vie.
L’azathioprine et l’allopurinol peuvent-ils être pris ensemble sans danger ?
Oui, mais seulement avec une dose réduite d’azathioprine (25-33 % de la dose habituelle) et un suivi rigoureux. À dose complète, la combinaison peut causer une suppression médullaire grave. À dose ajustée, elle est sûre et efficace pour les patients hyperméthylateurs.
Quels sont les signes d’une surdose de cette combinaison ?
Les signes de suppression médullaire incluent : fièvre inexpliquée, fatigue intense, ecchymoses faciles, saignements des gencives ou nez, et infections répétées. Si vous avez l’un de ces symptômes, arrêtez le traitement et consultez immédiatement votre médecin. Un bilan sanguin rapide peut confirmer une baisse des globules blancs.
Faut-il faire un test de TPMT avant de commencer l’LDAA ?
C’est recommandé, mais pas toujours suffisant. Le test de TPMT indique si vous avez une activité enzymatique élevée, mais le test des métabolites (6-TGN et 6-MMP) est plus précis. Idéalement, faites les deux : TPMT en début de traitement, puis métabolites à la semaine 4.
Combien de temps faut-il pour voir les résultats de l’LDAA ?
Les enzymes hépatiques commencent à baisser en 2 à 4 semaines. La réduction de l’inflammation intestinale prend plus de temps - généralement 8 à 12 semaines. La rémission clinique est souvent atteinte entre le 3e et le 6e mois.
Cette combinaison fonctionne-t-elle pour l’hépatite auto-immune ?
Oui. Une étude de 2023 publiée dans Hepatology a montré que 82 % des patients atteints d’hépatite auto-immune qui ne répondaient pas à l’azathioprine seule ont atteint la rémission avec l’LDAA. C’est désormais une option reconnue pour cette maladie.
BERTRAND RAISON
janvier 29, 2026 AT 12:25Cette combo, c’est du n’importe quoi. J’ai vu un type se faire hospitaliser pour ça. Pas envie de jouer à la roulette russe avec mon foie.
Claire Copleston
janvier 30, 2026 AT 13:15On transforme un médicament en artefact mystique, comme si le corps humain était une machine à coudre qu’on peut réarranger avec un peu d’allopurinol et un souhait. La biologie n’est pas un script Python qu’on debug. 😅
Benoit Dutartre
janvier 30, 2026 AT 15:37Et si c’était juste une combine des labos pour vendre plus de tests ? Tu penses vraiment que 95% d’économie, c’est pas un piège ? Les big pharma, ils aiment les protocoles compliqués. Ça fait plus scientifique.
Régis Warmeling
janvier 31, 2026 AT 12:42Tout ce qu’on fait avec les médicaments, c’est tenter de rattraper une erreur de la nature. L’azathioprine n’est pas censée être comme ça. L’allopurinol, c’est juste un bouchon qu’on met sur une fuite. Mais la fuite, elle est toujours là. On soigne les symptômes du symptôme.
Jean-Michel DEBUYSER
janvier 31, 2026 AT 15:28Si tu as une maladie chronique et que tu ne demandes pas tes métabolites, t’es pas un patient, t’es un cobaye. Fais-toi tester. C’est pas compliqué. Et si ton médecin dit non, trouve-en un autre. Ta santé, c’est pas un bonus, c’est ton trésor.
Philippe Labat
février 1, 2026 AT 17:31En Algérie, on utilise ça depuis 2018 dans les hôpitaux publics. Personne ne parle de ça en France, mais ici, c’est la norme. Les gens vivent mieux, et le système coûte moins cher. Pourquoi on fait toujours comme si la science était un privilège occidental ? 🤔
Joanna Bertrand
février 3, 2026 AT 15:27J’ai fait ce protocole l’an dernier. J’ai eu une leucopénie à la semaine 6. J’ai arrêté 10 jours, repris à 37,5 mg, et maintenant je vais bien. C’est pas magique, mais c’est possible. Faut juste être patient et rigoureux.